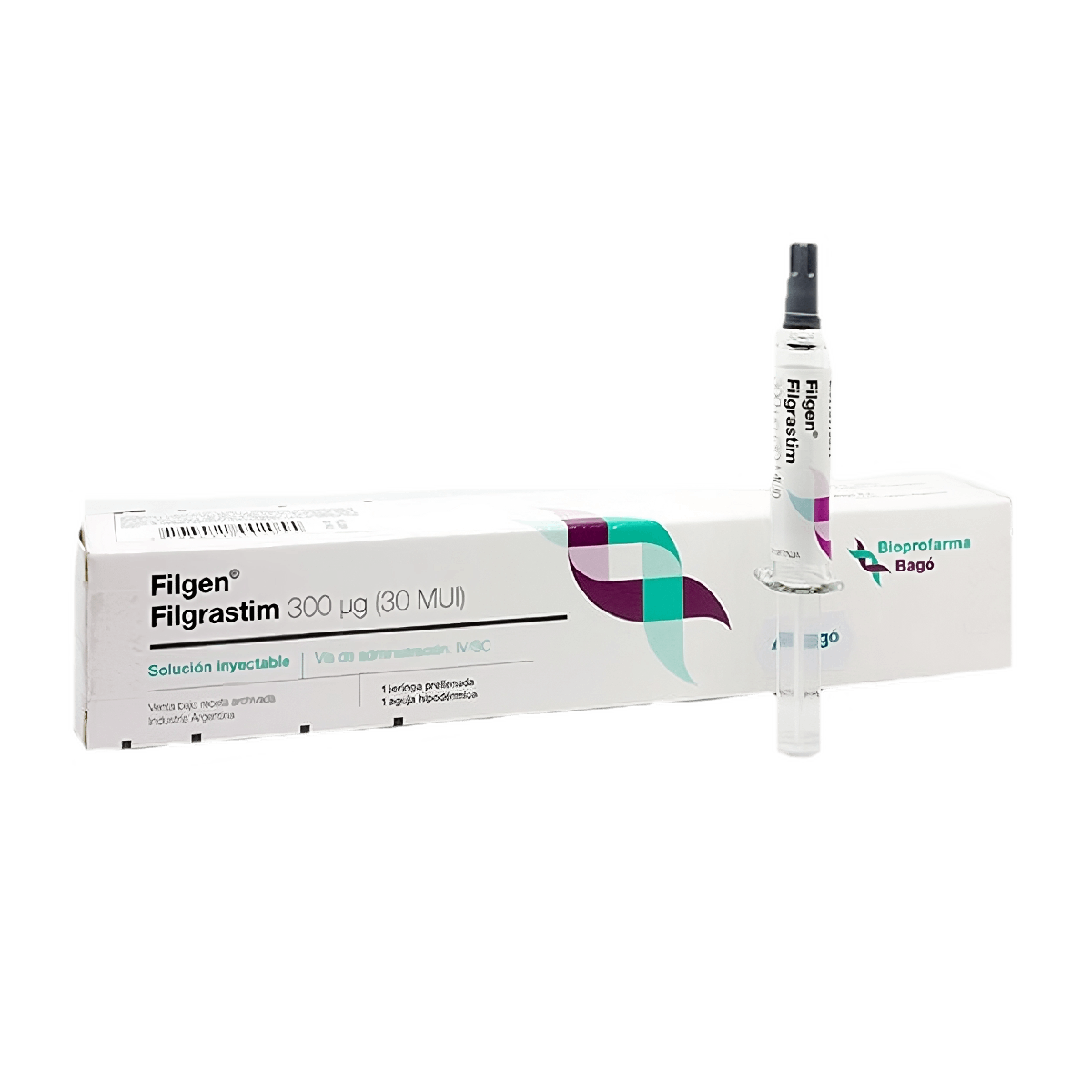
PRINCIPIO ACTIVO
Filgrastim 300 µg.
TIPO
Solución inyectable.
PRESENTACIÓN
Frasco ampolla y jeringa prellenada con 30 MUI en 1 ml de solución inyectable.
ACCIÓN TERAPÉUTICA
Factor estimulante del crecimiento de colonias granulocíticas.
Description
Description
FÓRMULA
Cada frasco ampolla contiene:
Filgrastim (r-Hu-Met-G-CSF) 300 µg.
Acetato de Sodio 0,8203 mg.
Sorbitol 50 mg.
Polisorbato 80 0,004%.
Acido Acético c.s.p. pH=4.
Agua para Inyectables c.s.p. 1 ml.
INDICACIONES
Filgen está indicado para reducir la duración de la neutropenia y la incidencia de neutropenia febril en pacientes tratados con quimioterapia citotóxica convencional con enfermedades malignas (con la excepción de leucemia mieloide crónica y síndromes mielodisplásicos) y en la reducción de la duración de la neutropenia en los pacientes sometidos a tratamiento mieloablativo seguido de trasplante de médula ósea y que se considere presenten un mayor riesgo de experimentar neutropenia grave prolongada.
La eficacia y seguridad de filgrastim es similar en adultos y en niños que están recibiendo quimioterapia citotóxica.
Filgen está indicado para la movilización de células progenitoras hematopoyéticas en sangre periférica (PBPC).
En pacientes, tanto niños como adultos, con neutropenia congénita grave, cíclica o idiopática con un recuento absoluto de neutrófilos (RAN) ≤500/mm3, y antecedentes de infecciones graves o recurrentes, la administración prolongada de filgrastim está indicada para aumentar el recuento de neutrófilos y reducir la incidencia y duración de episodios infecciosos.
Filgen está indicado para el tratamiento de la neutropenia persistente (RAN igual o inferior a 1.000/mm3) en pacientes con infección avanzada por el VIH, para reducir el riesgo de desarrollar infecciones bacterianas cuando otras opciones para tratar la neutropenia no sean adecuadas.
POSOLOGÍA Y FORMA DE ADMINISTRACIÓN
La terapia con Filgen solo debe administrarse en colaboración con un centro con experiencia en el tratamiento con G–CSF (Factor estimulante de las colonias de granulocitos) y que tenga las instalaciones diagnósticas necesarias. Los procedimientos de monitoreo y aféresis deben realizarse en colaboración con un centro hemato–oncológico con experiencia aceptable en este campo y donde el monitoreo del progenitor hematopoyético puede realizarse correctamente.
Pacientes con cáncer que reciben quimioterapia citotóxica
La dosis recomendada de Filgen es de 5 μg/kg/día. La primera dosis de Filgen deberá administrarse a partir de las 24 horas siguientes de finalizada la quimioterapia citotóxica. El tratamiento diario con Filgen debe continuarse hasta que se haya superado el punto mínimo previsto para el recuento de neutrófilos y este haya vuelto a valores normales. Tras la quimioterapia convencional en tumores sólidos, linfomas y leucemias linfocíticas, se requiere un tratamiento de hasta 14 días para alcanzar este objetivo. Después del tratamiento de inducción y consolidación de la LMA, la duración del tratamiento puede ser considerablemente mayor (hasta de 38 días) dependiendo del tipo, la dosis y el esquema de quimioterapia aplicado. En los pacientes sometidos a quimioterapia citotóxica suele observarse un aumento transitorio en el recuento de neutrófilos que ocurre típicamente 1 a 2 días después de iniciar la administración de filgrastim. Sin embargo, si se desea obtener una respuesta terapéutica sostenida, no se debe suspender el tratamiento con filgrastim hasta que haya superado el punto mínimo previsto para que la cifra de neutrófilos regrese a valores normales. No se recomienda, por lo tanto, la interrupción prematura del tratamiento con filgrastim antes de haber pasado el punto mínimo previsto para la cifra de neutrófilos.
Modo de administración:
Filgen puede administrarse una vez al día en forma de inyección SC o diluido en solución de dextrosa al 5% como infusión IV administrada en 30 minutos. La vía SC es preferida en la mayoría de los casos. De acuerdo con un estudio de administración de dosis únicas, la vía IV puede acortar la duración del efecto. Se desconoce cuál podría ser la relevancia clínica de este dato para la administración del fármaco en dosis múltiples. La elección de la vía de administración más adecuada dependerá de las circunstancias clínicas de cada paciente.
Pacientes sometidos a trasplante de médula ósea
La dosis recomendada de Filgen luego de un TMO es de 10 μg/kg/día. La primera dosis debe aplicarse al menos 24 horas después de la quimioterapia citotóxica y al menos 24 horas después de la infusión de la médula ósea. Una vez superado el punto mínimo esperado en el recuento de neutrófilos, la dosis diaria de Filge debe ajustarse de acuerdo con la respuesta de los neutrófilos de la siguiente forma:
Si es >1.000/mm³ por tres días consecutivos, disminuir a 5 µg/kg/día.
Si el recuento permanece >1.000/mm3 por tres días consecutivos más, suspender tratamiento con Filgen.
Si disminuye <1.000/mm3 durante el tratamiento, aumentar la dosis según los pasos arriba indicados.
Modo de administración:
Filgen puede ser administrado como infusión IV en 30 minutos o 24 horas, o bien, administrado por infusión SC continua por 24 horas. Filgen debe ser diluido en 20 ml de solución de glucosa al 5%.
Pacientes sometidos a recolección de progenitores celulares periféricos.
La dosis recomendada de Filgen para la movilización de progenitores de médula ósea en sangre periférica, cuando se utiliza solo, es de 10 μg/kg/día, durante 5 a 7 días consecutivos. Ritmo de leucocitaféresis: generalmente suele bastar con una o dos leucocitaféresis en los días 5 y 6. En otras circunstancias, puede ser necesaria leucocitaféresis adicional. La administración de Filgen debe mantenerse hasta la última leucocitaféresis. La dosis recomendada de Filgen, para movilizar células progenitoras hematopoyéticas tras una quimioterapia mielosupresora, es de 5 μg/kg/día, desde el primer día tras concluir la quimioterapia hasta que se haya superado el punto mínimo previsto en el recuento de neutrófilos y este haya vuelto a los valores normales. Se debe realizar la leucocitaféresis en el periodo comprendido en que el recuento de neutrófilos aumento desde <500/mm3 a >5.000/mm3. En aquellos pacientes que no hayan sido sometidos a quimioterapia intensiva, suele ser suficiente una leucocitaféresis. En otras circunstancias se recomiendan leucocitaféresis adicionales.
Modo de administración:
Filgen para la movilización de células hematopoyéticas en sangre periférica, cuando se utiliza solo: puede administrarse como infusión subcutánea continúa por 24 horas o inyección subcutánea. Para infusiones, Filgen debe ser diluido en 20 ml de solución de glucosa al 5%. Filgen para la movilización de células hematopoyéticas en sangre periférica posterior a quimioterapia mielosupresora: Filgen debe ser administrado mediante inyección subcutánea.
Movilización de células hematopoyéticas en donantes sanos de forma previa al trasplante alogénico de células progenitoras hematopoyéticas periféricas
La dosis de Filgen debe ser de 10 μg/kg/día durante 4 o 5 días consecutivos. La leucocitaféresis debe iniciarse el día 5 y continuarse el día 6 si fuera necesario para obtener 4 x 106 células CD34+/kg de peso del receptor.
Modo de administración:
Inyección SC.
Pacientes con neutropenia crónica grave (NCG)
Neutropenia congénita:
La dosis recomendada de inicio es de 12 μg/kg/día, que se administra como dosis única o en varias dosis.
Neutropenia cíclica o idiopática:
La dosis recomendada de inicio es de 5 μg/kg/día, que se administra en dosis única o repartida en varias dosis.
Ajuste de dosis:
Filgen debe administrarse diariamente por inyección SC hasta que el recuento de neutrófilos se estabilice por encima de 1.500/mm3. Una vez alcanzada la respuesta debe determinarse la dosis mínima efectiva para mantener esta cifra. La administración diaria y prolongada es requerida para mantener un recuento de neutrófilos adecuado. Al cabo de 1 a 2 semanas de terapia, la dosis inicial puede disminuirse a la mitad o aumentarse al doble, dependiendo de la respuesta del paciente. A partir de entonces, la dosis se puede ajustar en forma individual cada 1 a 2 semanas con el fin de mantener la cifra de neutrófilos entre 1.500/mm3 y 10.000/mm3. En pacientes con infecciones graves se puede proceder a un aumento más rápido de la dosis. En ensayos clínicos realizados con Filgrastim, el 97% de los pacientes que respondieron al tratamiento presentaron una respuesta completa a dosis ≤24 μg/kg/día. En pacientes con neutropenia crónica grave, no se estableció la seguridad a largo plazo de la administración de filgrastim con dosis superiores a 24 μg/kg/día.
Modo de administración:
Inyección SC.
Pacientes con infección por VIH
Para corregir la neutropenia:
La dosis inicial recomendada de Filgen es de 1 μg/kg/día ajustando hasta un máximo de 4 μg/kg/día hasta alcanzar y mantener una cifra normal de neutrófilos (RAN >2.000/mm3). En ensayos clínicos realizados con Filgrastim, >90% de los pacientes respondieron a estas dosis, recuperándose de la neutropenia en un tiempo mediano de 2 días. En un pequeño número de pacientes (<10%) se necesitaron dosis de hasta 10 μg/kg/día para la corrección de la neutropenia. Para mantener la cifra de neutrófilos dentro de la normalidad. Una vez corregida la neutropenia, debe determinarse la dosis mínima eficaz necesaria para mantener una cifra normal de neutrófilos. Se recomienda ajustar la dosis inicial a 300 μg/día a días alternos. En ocasiones puede ser necesario seguir ajustando la dosis de acuerdo con el RAN del paciente, para mantener el número de neutrófilos >2.000/mm3. En ensayos clínicos realizados con Filgrastim, se requirió la administración de 300 μg/día de 1 a 7 días por semana para mantener el RAN >2.000/mm3, siendo la mediana en la frecuencia de administración de 3 días a la semana. Puede ser necesaria
una administración prolongada para mantener el RAN >2.000/mm3.
Modo de administración:
Inyección SC.
Ancianos
Los estudios clínicos con filgrastim incluyeron un pequeño número de pacientes ancianos y no se realizaron estudios específicos en este grupo etario. Por lo tanto, no pueden establecerse recomendaciones específicas de posología.
Pacientes con insuficiencia renal
Los estudios con filgrastim en pacientes con insuficiencia renal o disfunción hepática grave demuestran un perfil farmacocinético y farmacodinámico similar al observado en individuos normales. El ajuste de dosis no es recomendado en estas circunstancias.
Uso pediátrico en la neutropenia crónica grave (NCG) y cáncer
El 65% de los pacientes estudiados en el programa de ensayos clínicos sobre NCG fueron menores de 18 años. La eficacia del tratamiento fue evidente en este grupo etario, que incluyó a una mayoría de pacientes con neutropenia congénita. No se observó ninguna diferencia en el perfil de seguridad en los pacientes pediátricos en tratamiento para NCG. Los datos de ensayos clínicos en pacientes pediátricos indican que la seguridad y eficacia de filgrastim son similares en adultos y niños tratados con quimioterapia citotóxica.
Las dosis recomendadas en pacientes pediátricos tratados con quimioterapia citotóxica mielosupresora son las mismas que en adultos.
Modo de administración:
Cuando se alcanzan concentraciones entre 5 y 15 μg/ml, este debe ser protegido de la adsorción a materiales plásticos mediante la adición de albúmina humana, para llegar a una concentración final de 2 mg/ml. Cuando se diluye en D/A 5% o D/A 5% más albúmina, filgrastim es compatible con frascos de vidrio, PVC, bolsas de poliolefina y jeringas de polipropileno. No se recomienda la dilución del filgrastim a una concentración final menor a 5 μg/ml.
FILGRASTIM NO DEBE SER DILUIDO EN SOLUCIÓN SALINA.
ADVERTENCIAS Y PRECAUCIONES
Filgrastim no debe aplicarse para aumentar la dosis de la quimioterapia citotóxica más allá de los esquemas de dosificación establecidos. Filgrastim no debe aplicarse a pacientes con NCG que desarrollen leucemia o tengan evidencia de evolución leucémica. Se reportó hipersensibilidad, incluyendo reacciones anafilácticas, en pacientes tratados con filgrastim, tanto con tratamientos iniciales como subsecuentes. Suspender filgrastim en forma permanente en pacientes con hipersensibilidad clínica significativa. No administre filgrastim a pacientes con antecedentes de hipersensibilidad a filgrastim. Como con todas las proteínas terapéuticas, existe un potencial para inmunogenicidad. La frecuencia de generación de anticuerpos contra filgrastim es generalmente baja. Pueden producirse anticuerpos de unión como es esperado con todos los tratamientos biológicos, sin embargo, no se han asociado con actividad neutralizante.
Crecimiento de células malignas
El factor estimulante de colonias de granulocitos puede promover el crecimiento in vitro de las células mieloides y se han observado efectos similares en algunas células no mieloides in vitro. La seguridad y eficacia de la administración de filgrastim en pacientes con síndromes mielodisplásicos o leucemia mieloide crónica (LMC) no se conoce todavía. El uso de filgrastim no está indicado en estas enfermedades. Se debe poner atención especial para distinguir el diagnóstico de leucemia mieloide crónica (LMC) en transformación blástica del de leucemia mieloide aguda (LMA).
Debido a los pocos datos disponibles sobre la seguridad y eficacia en pacientes con leucemia mieloide aguda (LMA) secundaria, filgrastim debe administrarse con precaución. No se ha determinado la seguridad y eficacia de la administración de filgrastim en pacientes con LMA de novo menores de 55 años y con citogenética favorable (t(8;21),t(15;17) e inv (16)).
Otras precauciones especiales:
El monitoreo de la densidad ósea puede estar indicado en pacientes que presenten enfermedad osteoporótica de base y sean tratados con filgrastim por más de 6 meses. Se han notificado efectos adversos pulmonares, en particular, enfermedad del intersticio pulmonar, tras la administración de G-CSF. Pacientes con antecedentes recientes de infiltrados pulmonares o neumonía atípica pueden presentar mayor riesgo. La aparición de síntomas respiratorios tales como tos, fiebre y disnea, en asociación con signos radiológicos de infiltración y deterioro en la función pulmonar, pueden ser los síntomas preliminares del síndrome de distrés respiratorio agudo (SRDA). Se deberá suspender la administración de filgrastim y administrar el tratamiento apropiado. Se ha notificado síndrome de leak capilar tras la administración de factores estimulantes de colonias de granulocitos, que se caracteriza por hipotensión, hipoalbuminemia, edema y hemoconcentración. Pacientes que desarrollen estos síntomas del síndrome de leak capilar deben ser supervisados estrechamente y recibir tratamiento sintomático estándar, que puede incluir cuidados intensivos. Se han comunicado reportes de glomerulonefritis en pacientes tratados con filgrastim. En general, estos episodios de glomerulonefritis se han resuelto posteriormente a la disminución en la dosis o suspensión de filgrastim. Se recomienda la monitorización del análisis de orina.
Precauciones especiales en pacientes con cáncer
Se han reportado casos poco frecuentes de esplenomegalia y ruptura esplénica tras la administración de filgrastim. Algunos casos de ruptura esplénica fueron fatales. Debe considerarse el diagnóstico de esplenomegalia o ruptura esplénica en pacientes tratados con filgrastim que reporten dolor en la parte superior izquierda del abdomen y/o dolor en el extremo del hombro.
Leucocitosis:
Recuentos leucocitarios de 100.000/mm3 o superiores, se han observado en menos del 5% de los pacientes que recibieron filgrastim en dosis superiores a 3 μg/kg/día. No se ha observado ningún efecto adverso directamente atribuible a este grado de leucocitosis. Sin embargo, dada la posibilidad de que aparezcan reacciones asociadas con leucocitosis intensa, debe controlarse periódicamente el recuento de leucocitos en intervalos regulares durante la terapia con Filgen. Si el recuento leucocitario supera los 50.000/mm3, después del nadir, se debe suspender la administración de Filgen inmediatamente. Sin embargo, durante el periodo de administración de filgrastim para la movilización de células progenitoras hematopoyéticas en sangre periférica, la administración de filgrastim debe suspenderse o reducir la dosis si el recuento de leucocitos aumenta por arriba de 70.000/mm3.
Riesgos asociados con el aumento de la dosis de quimioterapia:
Se debe tener especial cuidado cuando se administran dosis altas de quimioterapia, ya que no se ha demostrado una mejoría en los resultados obtenidos sobre el tumor y la intensificación de la quimioterapia puede conducir a efectos de mayor toxicidad cardiaca, pulmonar, neurológica o dermatológica. El tratamiento con filgrastim solo, no evita la trombocitopenia y anemia secundaria a la quimioterapia mielosupresora. Pacientes tratados con quimioterapia en dosis altas, pueden estar en mayor riesgo de trombocitopenia y anemia.
Se recomienda vigilar periódicamente el recuento plaquetario y el valor del hematocrito. Deben tomarse medidas de precaución especiales cuando se administren quimioterapéuticos como monoterapia o combinados que causan trombocitopenia grave. Se ha demostrado que el uso de células progenitoras hematopoyéticas en sangre periférica movilizadas por filgrastim reduce la intensidad y duración de la trombocitopenia tras la quimioterapia mieloablativa o mielosupresora.
Otras precauciones especiales:
Se desconocen aún los efectos de filgrastim en pacientes con disminución considerable de los progenitores mieloides. Filgrastim actúa principalmente sobre los precursores de los neutrófilos, lo cual se traduce en un aumento del número de neutrófilos circulantes. Por eso, la respuesta al medicamento podría ser menor en los pacientes con disminución de las células precursoras (como aquellos sometidos a radioterapia o quimioterapia intensivas, o aquellos con infiltración neoplásica de la médula ósea).
Se han reportado ocasionalmente trastornos vasculares, incluyendo enfermedad venoclusiva y alteraciones en el volumen de los fluidos, en pacientes sometidos a altas dosis de quimioterapia seguida de trasplante. Han sido reportados casos de enfermedad de injerto contra el huésped y muertes en pacientes que recibían G-CSF tras la realización de trasplante alogénico de médula ósea. El aumento de la actividad hematopoyética de la médula ósea en respuesta a la terapia con factor de crecimiento, ha sido asociado con resultados anormales transitorios en escaneos óseos. Esto debe ser considerado cuando se interpreten resultados de imágenes óseas.
Precauciones especiales en pacientes sometidos a movilización de células progenitoras hematopoyéticas en sangre periférica.
Movilización:
No existen estudios comparativos, prospectivos, aleatorizados entre los dos métodos de movilización recomendados (filgrastim solo, o en combinación con quimioterapia mielosupresora) dentro de la misma población de pacientes. Dada la variabilidad individual entre pacientes y la variabilidad interanalítica de los recuentos de células CD34+, resulta difícil establecer una comparación directa entre los diferentes estudios. Es difícil, por lo tanto, recomendar un método óptimo. La elección del método de movilización debe realizarse de acuerdo con los objetivos del tratamiento para cada paciente en particular.
Exposición previa a agentes citotóxicos:
Los pacientes que han sido sometidos a una terapia mielosupresora intensiva previa, pueden no presentar una movilización suficiente de células progenitoras hematopoyéticas como para conseguir el rendimiento mínimo recomendado (≥2,0 x 106 células CD34+/ kg) o aceleración en la recuperación plaquetaria, en el mismo grado. Algunos agentes citotóxicos muestran toxicidad especial en el reservorio de células progenitoras hematopoyéticas y pueden afectar negativamente la movilización de las células progenitoras. Agentes tales como melfalán, carmustina (BCNU) y carboplatino administrados por periodos prolongados, antes de la movilización de las células progenitoras pueden reducir el rendimiento de este método. Sin embargo, si resulta eficaz para la movilización de células progenitoras hematopoyéticas la administración de melfalán, carboplatino o BCNU junto con filgrastim. Cuando se requiera efectuar trasplante de células progenitoras de sangre periférica, se recomienda planificar el procedimiento de movilización de células madre al comienzo del periodo de tratamiento del paciente.
En estos pacientes, antes de administrar altas dosis de quimioterapia, se prestará especial atención al número de células progenitoras movilizadas. Si los rendimientos no son adecuados, según el valor citado, se deben considerar otras formas alternativas de tratamiento que no requieran el soporte de células progenitoras.
Valoración del rendimiento de células progenitoras:
Se recomienda prestar especial atención al método de cuantificación para valorar el número de células progenitoras recolectadas en los pacientes tratados con filgrastim. Los resultados de los análisis de la citometría de flujo para determinar el número de células CD34+ varían en función de la precisión de la metodología usada, debiéndose interpretar con precaución las recomendaciones numéricas basadas en estudios realizados en otros laboratorios. Los análisis estadísticos de la relación entre el número de células CD34+ reinfundidas y la velocidad de recuperación plaquetaria tras altas dosis de quimioterapia indican que dicha relación es compleja pero continua. La recomendación de un rendimiento mínimo de ≥2,0 x 106 células CD34+/kg se basa en los datos publicados que consiguieron una recuperación hematológica suficiente. Los rendimientos superiores parecen estar en correlación con una recuperación más rápida, y los inferiores con una recuperación más lenta.
Precauciones especiales en donantes sanos sometidos a movilización de células hematopoyéticas
La movilización de células progenitoras hematopoyéticas periféricas no ofrece ningún beneficio clínico directo para los donantes sanos y solamente debe considerarse en el marco de un trasplante alogénico de células madre. La movilización de células progenitoras hematopoyéticas
periféricas solamente debe considerarse en donantes que cumplan los criterios de elegibilidad clínicos y de laboratorio para la donación de células madre prestando especial atención a los valores hematológicos y a las enfermedades infecciosas. La seguridad y eficacia de filgrastim en donantes sanos menores de 16 años o mayores de 60 años no está establecida.
Se han reportado casos muy frecuentes de trombocitopenia en pacientes que reciben filgrastim. Por lo tanto, el recuento de plaquetas debe controlarse de manera cercana. Después de la administración de filgrastim y los procesos de leucocitaféresis se ha observado trombocitopenia transitoria (plaquetas <100.000/mm3) en 35% de los pacientes estudiados. Entre ellos, se comunicaron dos casos con plaquetas<50.000/mm3 que se atribuyeron al procedimiento de leucocitaféresis. En caso de ser necesaria más de una leucocitaféresis, se debe prestar especial atención a los donantes que antes de la leucocitaféresis tengan plaquetas <100.000/mm3; en general no se recomienda hacer aféresis si las plaquetas están por debajo de 75.000/mm3.
No deben realizarse leucocitaféresis a donantes tratados con anticoagulantes o con trastornos hemostáticos. Debe suspenderse la administración de filgrastim o reducirse la dosis si el recuento de leucocitos supera los 70.000/mm3. Los donantes tratados con G-CSF para la movilización de células progenitoras hematopoyéticas deben ser vigilados estrechamente hasta que sus valores hematológicos regresen a la normalidad. En donantes sanos se han observado alteraciones citogenéticas transitorias después de recibir tratamiento con G-CSF. Se desconoce la trascendencia de estos cambios. Aun así, no se puede descartar el riesgo de estimulación de alguna clona mieloide maligna.
Se recomienda que el centro de aféresis lleve un control y seguimiento sistemático de los donantes de células madre durante al menos 10 años para asegurar el monitoreo de la seguridad a largo plazo. Se han descrito casos frecuentes pero generalmente asintomáticos de esplenomegalia y casos poco frecuentes de ruptura esplénica en donadores sanos (y pacientes), tras la administración de factores estimulantes de colonias de granulocitos (G-CSF). Algunos casos de ruptura esplénica fueron mortales. Por lo tanto, debe realizarse una cuidadosa monitorización clínica del tamaño del bazo (p. ej. examen clínico, ecografía).
Debe considerarse el diagnóstico de ruptura esplénica en los donadores y/o pacientes que refieran dolor abdominal superior izquierdo o en el extremo del hombro. En donadores sanos, se han reportado casos frecuentes de disnea y poco frecuentes de otras reacciones adversas pulmonares (hemoptisis, hemorragia pulmonar, infiltración pulmonar e hipoxia). En caso de sospecha o confirmación de reacciones adversas pulmonares, debería considerarse suspender la administración de filgrastim y administrar el tratamiento apropiado.
Precauciones especiales en los receptores de células progenitoras hematopoyéticas periféricas alógenas movilizadas con Filgrastim.
Los datos disponibles indican que las interacciones inmunitarias entre células progenitoras hematopoyéticas periféricas alógenas trasplantadas y el receptor pueden asociarse a un aumento del riesgo de enfermedad aguda o crónica del injerto contra el huésped en comparación con el trasplante de médula ósea.
Precauciones especiales en pacientes con NCG
Biometría hemática:
Se han notificado casos frecuentes de trombocitopenia en pacientes tratados con filgrastim. El recuento plaquetario debe controlarse cuidadosamente, sobre todo durante las primeras semanas de tratamiento con filgrastim. En pacientes que desarrollen trombocitopenia, es decir, en aquellos con un recuento de plaquetas persistentemente <100.000/mm3 debe valorarse la posibilidad de suspender el tratamiento con filgrastim de forma intermitente o, al menos, reducir la dosis. Existen también otros cambios en la biometría hemática como la anemia y el aumento transitorio de los progenitores mieloides que obligan a vigilar cuidadosamente el recuento celular.
Transformación hacia leucemia o síndrome mielodisplásico:
Se debe establecer cuidadosamente el diagnóstico de neutropenia crónica grave y diferenciarlo de otros trastornos hematopoyéticos como la anemia aplásica, mielodisplasia y leucemia mieloide. Antes del tratamiento debe realizarse una biometría hemática completa con fórmula leucocitaria y recuento de plaquetas, así como un estudio morfológico de la médula ósea y cariotipo. Se han descrito casos poco frecuentes (aproximadamente 3%) de síndrome mielodisplásico (SMD) o leucemia en pacientes con neutropenia crónica grave incluidos en ensayos clínicos y tratados con filgrastim. Esta observación sólo se ha hecho en pacientes con neutropenia congénita.
El síndrome mielodisplásico y las leucemias son complicaciones naturales de la enfermedad y su relación con el tratamiento de filgrastim es incierta. Un subgrupo de aproximadamente 12% de pacientes cuyas evaluaciones citogenéticas fueron normales a nivel basal, presentaron posteriormente anormalidades, incluyendo monosomía 7, en la evaluación repetida de rutina. No está claro en la actualidad si el tratamiento mantenido de los pacientes con NCG predispone a éstos hacia anormalidades citogenéticas, síndrome mielodisplásico o transformación leucémica. Se recomienda efectuar a los pacientes exámenes morfológicos y citogénicos de la médula ósea a intervalos regulares (aproximadamente cada 12 meses).
Otras precauciones especiales:
Se deben excluir las causas que provoquen neutropenia transitoria, como es el caso de las infecciones virales. Tras la administración de filgrastim se han reportado casos muy frecuentes de esplenomegalia, y casos frecuentes de ruptura esplénica. Debe considerarse el diagnóstico de esplenomegalia o ruptura esplénica en pacientes tratados con filgrastim que refieran dolor en la parte superior izquierda del abdomen o dolor en el extremo del hombro. La esplenomegalia es una consecuencia directa del tratamiento con filgrastim. Treinta y uno por ciento (31%) de los pacientes incluidos en estudios clínicos presentaron esplenomegalia detectable por palpación.
El aumento en el volumen del bazo, medido radiográficamente, se presentó al comienzo del tratamiento con filgrastim y tendió a estabilizarse. La progresión de la esplenomegalia disminuyó o se detuvo al reducir la dosis, y sólo en 3% de los pacientes se requirió esplenectomía. Se debe evaluar de forma regular el tamaño del bazo. Para detectar un aumento anómalo del volumen esplénico basta con realizar palpación abdominal. Hematuria fue reportada de manera frecuente y proteinuria ocurrió en un pequeño número de casos. Es necesario efectuar un análisis regular de orina para controlar estos acontecimientos. La seguridad y la eficacia de filgrastim no están establecidas en recién nacidos y en pacientes con neutropenia autoinmune.
Precauciones especiales en pacientes con infección por VIH
Se han notificado de manera frecuente casos de esplenomegalia tras la administración de filgrastim. Debe considerarse un diagnóstico de esplenomegalia o ruptura esplénica en individuos tratados con filgrastim que refieran dolor en la parte superior izquierda del abdomen o en el extremo del hombro.
Biometría hemática:
El recuento absoluto de neutrófilos (RAN) debe monitorizarse cuidadosamente, especialmente durante las primeras semanas de tratamiento con filgrastim. Algunos pacientes responden rápidamente a la dosis inicial de filgrastim con un aumento considerable en el recuento de neutrófilos. Se recomienda la evaluación diaria del RAN durante los 2 – 3 primeros días de la administración de filgrastim. Después, se recomienda que el RAN se evalúe al menos dos veces por semana durante las dos primeras semanas y posteriormente, una vez a la semana o una vez cada dos semanas durante la terapia de mantenimiento. Durante la administración intermitente de 300 μg/día de filgrastim pueden producirse amplias fluctuaciones en el RAN a lo largo del tiempo. Para determinar la cifra mínima de neutrófilos, se recomienda que se tomen muestras sanguíneas inmediatamente antes de cualquiera de las dosis pautadas de filgrastim.
Riesgos asociados con dosis más altas de medicamentos mielosupresores:
El tratamiento con filgrastim solo, no descarta la trombocitopenia ni la anemia causada por los medicamentos mielosupresores. Como resultado de la posibilidad de recibir dosis mayores o un número mayor de estos medicamentos con el tratamiento con filgrastim, el riesgo de trombocitopenia y anemia puede ser mayor. Se recomienda monitorear la biometría hemática periódicamente.
Mielodepresión de causa infecciosa o neoplásica:
La neutropenia puede deberse a infecciones oportunistas tales como el complejo Mycobacterium avium o a neoplasias tales como linfomas malignos que infiltran la médula ósea. En los pacientes que se conoce tienen infiltraciones infecciosas en la médula ósea o malignidad, se debe considerar la administración de un tratamiento adecuado para dichas condiciones, además de la administración de filgrastim para el tratamiento de la neutropenia. El efecto del filgrastim sobre la neutropenia causada por tumores o por infecciones con infiltración de la médula ósea, no está bien establecido.
Precauciones especiales en pacientes con anemia de células falciformes
Se han notificado crisis de anemia de células falciformes, en algunos casos fatales, en pacientes con anemia de células falciformes a los que se les ha administrado filgrastim. El médico deberá actuar con precaución al considerar la administración de filgrastim en pacientes con anemia de células falciformes.
Efectos sobre la capacidad para conducir y utilizar maquinaria
No se han realizado estudios de los efectos sobre la capacidad para conducir y utilizar maquinarias.
Fertilidad, embarazo y lactancia
Embarazo:
No existe o es limitada la información con respecto al uso de filgrastim en mujeres embarazadas. Estudios en animales han mostrado toxicidad reproductiva. Se ha observado una mayor incidencia de pérdidas embrionarias en conejos al utilizar dosis a altos múltiplos de la exposición clínica y en presencia de toxicidad materna. En la literatura hay publicaciones que demuestran el paso transplacentario de filgrastim en mujeres embarazadas. Filgen no está recomendado durante el embarazo.
Lactancia:
Se desconoce si filgrastim/metabolitos se excretan en la leche materna. El riesgo para los recién nacidos/infantes no puede ser excluido. Debe establecerse la decisión de suspender la lactancia o suspender/abstenerse de la terapia con Filgen, teniendo en cuenta el beneficio de la lactancia para el niño y el beneficio de la terapia para la mujer.
Fertilidad:
Filgrastim no afectó la capacidad reproductiva o la fertilidad en ratas hembra o macho.
Datos preclínicos sobre seguridad
Filgrastim fue evaluado en estudios de toxicidad de dosis repetidas de hasta 1 año de duración, lo que reveló cambios atribuibles a las acciones farmacológicas esperadas incluyendo aumento en leucocitos, hiperplasia mieloide en la medula ósea, granulopoyesis extramedular y aumento del tamaño del bazo. Todos estos cambios se revirtieron después de la suspensión del tratamiento. Los efectos de filgrastim en el desarrollo prenatal fueron estudiados en ratas y conejos. La administración intravenosa (80 μg/kg/día) de filgrastim a conejos durante el periodo de organogénesis fue tóxico para la madre y se observó incremento del aborto espontáneo, pérdida post-implantación y disminución en el tamaño promedio de la camada viva y el peso fetal.
En ratas preñadas, no se observó toxicidad materna o fetal en dosis de hasta 575 μg/kg/día. Las crías de ratas a las que se les administró filgrastim durante el periodo perinatal y de lactancia, exhibieron un retardo en la diferenciación externa y crecimiento (≥20 μg/kg/día) y una reducción ligera en la tasa de supervivencia (100 μg/kg/día). No se observaron efectos de filgrastim en la fertilidad de ratas macho y hembra.
Interacciones
Interacción con quimioterapia citotóxica mielosupresora
No se ha establecido definitivamente la seguridad y eficacia de filgrastim, administrado el mismo día que la quimioterapia citotóxica mielosupresora. No se recomienda el uso de Filgen entre las 24 horas previas y las 24 horas posteriores a la quimioterapia, debido a que las células mieloides en fase de replicación rápida son muy sensibles a la quimioterapia citotóxica mielosupresora. Los datos preliminares provenientes de un pequeño número de pacientes tratados simultáneamente con filgrastim y 5-fluorouracilo indican que se puede exacerbar la gravedad de la neutropenia. Todavía no se ha investigado en ensayos clínicos la posible interacción con otros factores de crecimiento hematopoyético y citocinas. Debido a que el litio estimula la liberación de neutrófilos, es probable que potencie el efecto de filgrastim. Aunque esta interacción no se ha investigado formalmente, no hay evidencia de que pueda ser nociva.
CONTRAINDICACIONES
Filgen está contraindicado en pacientes con hipersensibilidad conocida a proteínas derivadas de la E.coli, al filgrastim mismo, o a cualquier componente de la formulación.