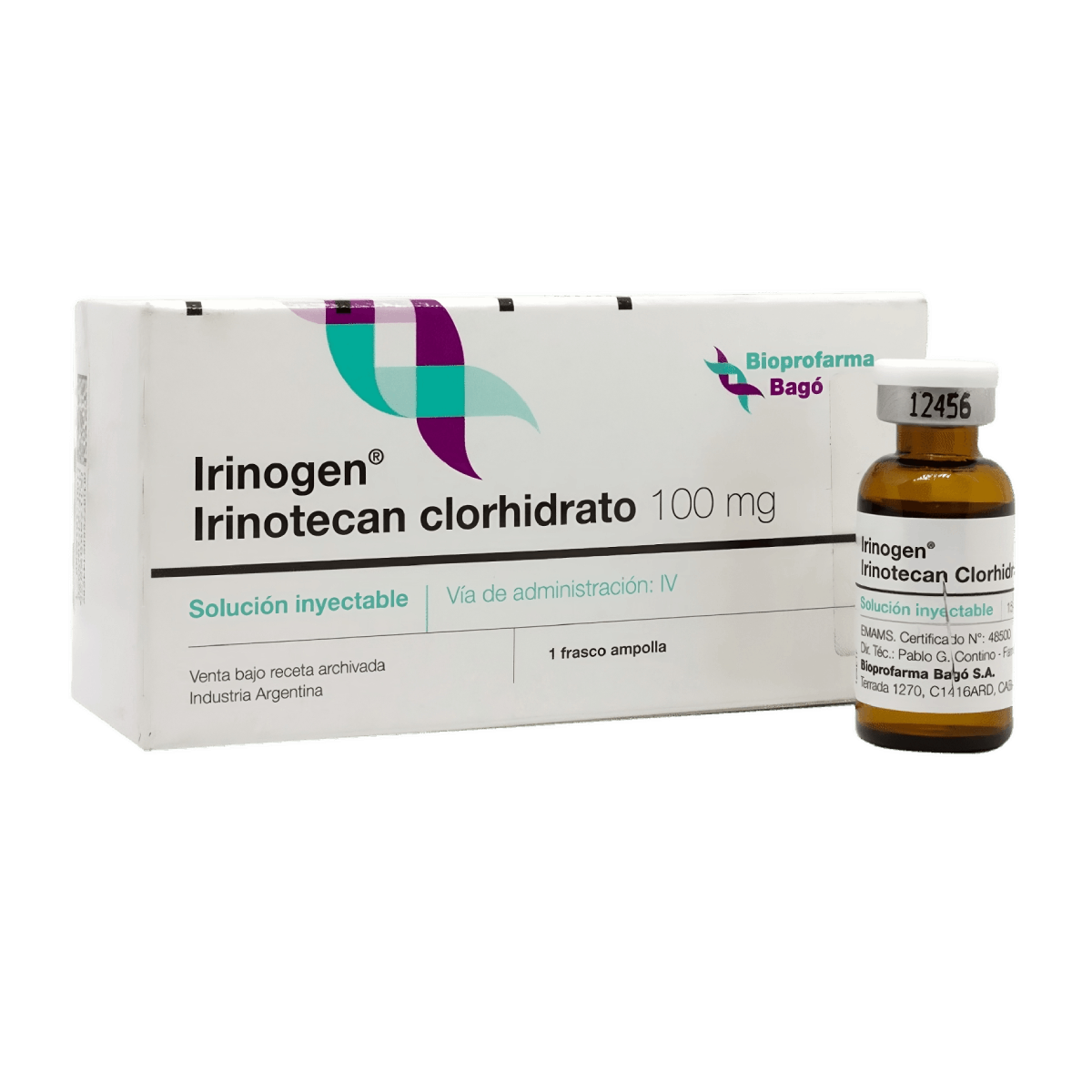
PRINCIPIO ACTIVO
Irinotecan Clorhidrato 100 mg.
TIPO
Solución inyectable.
PRESENTACIÓN
Envase con 1 frasco ampolla de 5 ml de solución inyectable para única dosis.
ACCIÓN TERAPÉUTICA
Antineoplásico.
Description
Description
FÓRMULA
Cada frasco ampolla contiene:
Irinotecan clorhidrato (trihidrato) 100 mg.
Sorbitol 225 mg.
Ácido láctico 4,5 mg.
Agua para inyectables c.s.p. 5 ml.
INDICACIONES
Irinogen está indicado para el tratamiento en primera línea en combinación con 5-Fluoruracilo (5-Fu) y leucovorina (LV), de pacientes con carcinoma metastático de colon o recto.
Irinogen también está indicado, en pacientes con carcinoma metastásico de colon o recto, cuya enfermedad recurrió o progresó luego de una terapia inicial con 5-Fu.
Irinogen, en forma concurrente con cetuximab está indicado en el tratamiento del cáncer colorrectal (KRAS wild type), que expresa el receptor del factor de crecimiento epidérmico (EGFR), en pacientes que no recibieron tratamiento previo para la enfermedad metastásica o en quienes progresaron luego de una terapia previa con irinotecan.
Irinogen en combinación con 5-Fu, acido folínico y bevacizumab está indicado en el tratamiento en primera línea de pacientes con carcinoma metastásico de colon o recto.
Irinogen en combinación con capecitabina con o sin bevacizumab está indicado en la terapia en primera línea de pacientes con carcinoma colorrectal metastásico.
POSOLOGÍA Y FORMA DE ADMINISTRACIÓN
Todas las dosis de Irinogen se deben administrar en forma de infusión intravenosa, durante 30 a 90 minutos.
Terapia de combinación
Régimen de dosis
– Irinogen en combinación con 5-Fu y LV. En todos los regímenes, primero se aplica la dosis de Irinogen, seguidamente de LV y posteriormente 5-Fu.
Irinogen se usará en la forma recomendada. Dosis de comienzo menores pueden ser consideradas para irinotecan (por ej. 100 mg/m2) y 5-FU (por ej. 400 mg/m2) en pacientes con cualquiera de las siguientes condiciones: 65 o más años, radioterapia previa extensa, estado de performance de 2 o niveles de bilirrubina aumentados. El tratamiento debería realizarse en ciclos de 6 semanas; 4 semanas de terapia y 2 semanas de descanso.
– Irinogen en combinación con Cetuximab. La dosis de cetuximab a administrar dependerá de la situación del paciente y el criterio médico. Normalmente, se usa la misma dosis de irinotecan que se administró en los últimos ciclos del régimen anterior que contenía irinotecan. El irinotecan no se debe administrar antes de pasada una hora de haber concluido la infusión de cetuximab.
– Irinogen en combinación con bevacizumab. La dosis de bevacizumab a administrar dependerá de la situación del paciente y el criterio médico. El bevacizumab se recomienda en combinación con el irinotecan (125 mg/m2) / bolo de 5-Fu (500 mg/m2)/LV (20 mg/m2), administrado una vez a la semana durante 4 semanas, cada 6 semanas.
– Irinogen en combinación con capecitabina. La dosis de capecitabina a administrar dependerá de la situación del paciente y el criterio médico. La capecitabina está recomendada en combinación con irinotecan en una dosis inicial de 1000 mg/m2 por 2 semanas cada 3 semanas.
Modificación de la dosis
Los pacientes deben ser cuidadosamente monitoreados para determinar la toxicidad antes de cada tratamiento. De acuerdo con los niveles de dosis recomendados descriptos en la tabla de esquemas de combinación de dosis-agente y modificaciones de la dosis, las dosis posteriores serán ajustadas como se sugiere en la tabla de modificaciones de las dosis recomendadas para los planes de combinación. La dosis de Irinogen y 5-Fu deben ser modificadas de ser necesario para ajustar la dosis a la tolerancia del paciente. Todas las modificaciones de las dosis se basarán en la peor toxicidad precedente. Los nuevos ciclos de quimioterapia no deberán comenzar hasta que la toxicidad sea de grado 2 o menor, según criterios del Instituto Nacional de Cáncer (NCI). La terapia se puede retrasar de 1 a 2 semanas, para permitir la recuperación de la toxicidad relacionada con el tratamiento. Si el paciente no se recupera, se debe considerar la discontinuación del tratamiento. De no presentarse episodios de toxicidad importantes, la terapia con ciclos adicionales de irinotecan/ 5-Fu /LV puede continuar en forma indefinida mientras que los pacientes sigan experimentando un beneficio clínico. En combinación con capecitabina, para pacientes de 65 años o más, se recomienda una disminución de la dosis inicial de capecitabina a 800 mg/m2 dos veces por día, según la información de capecitabina.
Esquemas de dosis, como monoterapia
Irinogen debe administrarse por vía intravenosa en una infusión de 90 minutos, tanto para los esquemas de aplicación cada 3 semanas, como para los esquemas semanales. La disminución en la dosis inicial por un nivel de dosis de Irinogen se consideraría en pacientes que presenten cualquiera de las siguientes condiciones: edad igual o mayor a 65 años, radioterapia pélvica /abdominal previa, estado de performance de 2 o aumento en los niveles de bilirrubina. Se recomienda que los pacientes reciban premedicación con agentes antieméticos. La administración profiláctica o terapéutica de atropina debería ser considerada en pacientes que experimenten síntomas colinérgicos.
Modificaciones de la dosis
Se controlará cuidadosamente a los pacientes para determinar la toxicidad, modificándose las dosis de Irinogen según corresponda, de modo de adaptarlas a la tolerancia individual al tratamiento. En base a los niveles de dosis recomendados en la tabla de regímenes de monoterapia y modificaciones de la dosis, las dosis posteriores serán ajustadas como lo sugiere la tabla de modificaciones recomendadas de las dosis para los regímenes de monoterapia. Todas las modificaciones de las dosis se basarán en la peor toxicidad precedente. No se dará comienzo a un nuevo ciclo de terapia hasta que la toxicidad se haya recuperado a NCI grado 2 o menos. El tratamiento se demoraría de 1 a 2 semanas, para permitir la recuperación del paciente de la toxicidad relacionada al tratamiento. Si el paciente no se recupera, se debería considerar la discontinuación de esta terapia. Siempre que no se desarrolle una toxicidad intolerable, el tratamiento con ciclos adicionales de Irinogen podría continuarse indefinidamente, en la medida que los pacientes sigan beneficiándose desde el punto de vista clínico.
Dosis en pacientes con disminución de la actividad de la UGT1A1
Se debe considerar por lo menos la disminución de un nivel de la dosis inicial en aquellos pacientes que presenten el alelo UGT1A1*28 homocigota, cuando se administre irinotecan como monodroga o en esquemas de combinación. Sin embargo, no se conoce la disminución de la dosis precisa y las subsiguientes modificaciones en la dosis deben considerarse sobre la base de la tolerancia individual de cada paciente a la terapia.
Poblaciones especiales
Pacientes con deterioro de la función hepática
Ver plan de dosis con agente único.
Pacientes con deterioro de la función renal
No se han realizado estudios en esta población. Por lo tanto, se deberá tener precaución en los pacientes con deterioro de la función renal. El uso de irinotecan no está recomendado en pacientes en diálisis.
Precauciones en la preparación y administración
Como ocurre con otras drogas oncológicas, se debe tener cuidado en el manejo y preparación de las soluciones para la infusión de Irinogen. Se recomienda el uso de guantes. Si la solución de Irinogen entra en contacto con la piel, se debe lavar inmediatamente el área con abundante agua y jabón. Si Irinogen entra en contacto con las membranas mucosas, se debe lavar con abundante cantidad de agua.
Preparación de la solución para infusión
Se debe revisar el contenido del frasco para detectar la presencia de partículas y repetir esta observación cuando el producto se extraiga del frasco hacia la jeringa. La solución inyectable de Irinogen 20 mg/ml, se debe utilizar solo una vez y cualquier porción no utilizada debe descartarse.
La solución inyectable de Irinogen debe ser diluida antes de la infusión, preferentemente en una solución de Dextrosa inyectable al 5 %, o en una solución al 0,9% de cloruro de sodio inyectable, para obtener una concentración final entre 0,12 y 2,8 mg/ml. La solución es química y físicamente estable durante 24 horas a temperatura ambiente (25 °C aproximadamente) y con luz fluorescente. Las soluciones diluidas en dextrosa 5%, almacenadas en condiciones de refrigeración (2 °C a 8 °C) y protegidas de la luz, son física y químicamente estables durante 48 horas.
No se recomienda refrigerar soluciones preparadas en cloruro de sodio 0,9% inyectable debido a reportes esporádicos y de baja incidencia de aparición de partículas visibles. Se debe evitar que el Irinogen y sus mezclas se congelen, ya que esto puede favorecer la precipitación de la droga. La dilución debe realizarse bajo estrictas condiciones de asepsia (por ejemplo, cámara de flujo laminar). Para preservar las mezclas de Irinogen que fueron diluidas, de una posible contaminación bacteriana, se recomienda su utilización dentro de las 6 horas de preparadas cuando se conservan a temperatura ambiente. No se deben agregar otras drogas a la infusión. Las drogas para administración parenteral deben ser inspeccionadas en forma visual para observar la presencia de partículas o decoloración, antes de su administración, siempre y cuando lo permita la solución y el recipiente.
ADVERTENCIAS Y PRECAUCIONES
Advertencias Generales
Irinotecan no debe utilizarse en combinación con el esquema de la “Clínica Mayo” de 5-Fu/LV (administración durante 4 a 5 días consecutivos cada 4 semanas), ya que se reportó un aumento en la toxicidad, incluso muertes por toxicidad.
Administración
El irinotecan debe administrarse bajo la supervisión de un médico con experiencia en el uso de agentes quimioterápicos contra el cáncer. Solo es posible resolver rápidamente las complicaciones cuando existen medios adecuados de diagnóstico y tratamiento. El irinotecan solo debe prescribirse en los siguientes casos una vez que se hayan ponderado los beneficios esperados en función de los posibles riesgos terapéuticos:
– En pacientes con un factor de riesgo, especialmente en aquellos con un estado general de la OMS=2.
– En los pocos casos aislados en que se considera que es improbable que el paciente cumpla con las recomendaciones en materia de manejo de los eventos adversos (necesidad de tratamiento antidiarreico inmediato y prolongado combinado con un consumo elevado de líquidos en el momento de la aparición de la diarrea tardia). Se recomienda una estricta supervisión hospitalaria de dichos pacientes.
Síntomas colinérgicos
Los pacientes pueden tener síntomas de rinitis, aumento de la salivación, miosis, lagrimeo, diaforesis, rubefacción (vasodilatación), bradicardia e hiperperistaltismo intestinal capaz de causar cólicos abdominales y diarrea temprana (es decir, diarrea que generalmente se produce durante o dentro de las 8 horas posteriores a la administración del irinotecan). Estos síntomas pueden observarse durante o poco después de la infusión de irinotecan, se consideran relacionados con la actividad anticolinesterasa del compuesto madre del irinotecan y es de esperar que ocurran más frecuentemente con las dosis más elevadas de irinotecan. Debe considerarse la administración terapéutica o profiláctica de 0,25 a 1 mg de atropina por vía IV o subcutánea (SC) (a menos que este clínicamente contraindicada) en los pacientes que experimentan síntomas colinérgicos.
Extravasación
Si bien el irinotecan no es un vesicante conocido, se debe tener precaución a fin de evitar la extravasación y se debe controlar el sitio de aplicación para detectar signos de inflamación. En caso de extravasación, se recomienda enjuagar la zona y aplicar hielo.
Hepáticas
En estudios clínicos se observaron anormalidades de las enzimas hepáticas grado 3 o 4 de los criterios de toxicidad comunes (CTC) del Instituto Nacional de Cáncer (NCI) en menos del 10% de los pacientes. Estos eventos ocurren típicamente en los pacientes con metástasis hepáticas conocidas y no han sido relacionados claramente con el irinotecan.
Hematológicas
Comúnmente el irinotecan causa neutropenia, leucopenia y anemia, algunas de las cuales pueden ser severas y por ello no se debe usar en pacientes con insuficiencia severa de la médula ósea. La trombocitopenia seria es poco común. En los estudios clínicos, la frecuencia de neutropenia grado 3 y 4 del NCI fue significativamente mayor en los pacientes que habían recibido previamente irradiación pélvica /abdominal, que en los pacientes que no habían sido expuestos a esta irradiación. Los pacientes con niveles basales de bilirrubina sérica total de 1,0 mg/dl o más, también tuvieron una probabilidad significativamente mayor de neutropenia grado 3 o 4 en el primer ciclo de la terapia, que los pacientes con niveles de bilirrubina por debajo de 1,0 mg/dl. No hubo diferencias significativas entre la edad y el sexo en la frecuencia de neutropenia grado 3 o 4. La neutropenia febril (neutropenia grado 4 del NCI) concurrente con fiebre grado ≥2, ocurrió en menos del 10% de los pacientes en los estudios clínicos, sin embargo hubo reportes de muertes debidas a neutropenia severa seguida de sepsis en pacientes tratados con irinotecan. Las complicaciones neutropénicas deben ser manejadas rápidamente con soporte antibiótico. La terapia con Irinogen debe ser temporariamente discontinuada si ocurre neutropenia febril o si el recuento absoluto de neutrófilos cae por debajo de 1000/mm3. La dosis de Irinogen debe ser reducida si ocurre neutropenia clínicamente significativa.
Diarrea
El irinotecan puede inducir formas de diarrea temprana o tardía, que se producirían por diferentes mecanismos. La diarrea temprana (inicial) que ocurre dentro o durante las 8 horas de administrado el irinotecan es de naturaleza colinérgica. Puede ser severa pero por lo general es pasajera. Puede estar acompañada de síntomas como rinitis, aumento de la salivación, miosis, lacrimación, diaforesis, flushing e hiperperistalsis intestinal que puede causar calambres abdominales. La diarrea precoz y otros síntomas colinérgicos pueden ser prevenidos o disminuidos con la administración de atropina. La diarrea tardía ocurre generalmente luego de más de 8 horas de la última administración de irinotecan y puede ser prolongada, puede llevar a deshidratación, desbalance electrolítico o sepsis y puede amenazar la vida. En los estudios clínicos probando el cronograma de dosis cada 3 semanas, la mediana del tiempo para el inicio de la diarrea tardía fue de 5 días después de la infusión de irinotecan.
En los estudios clínicos evaluando el cronograma de dosis semanal, la mediana de tiempo de inicio de diarrea tardía fue de 11 días después de la administración de irinotecan. Para los pacientes que inician tratamiento en la dosis semanal de 125 mg/m2, la mediana de la duración de cualquier grado de diarrea tardía fue de 3 días. Entre los pacientes tratados en la dosis semanal de 125 mg/m2 que experimentaron diarrea tardía grado 3 o 4, la mediana de la duración de todo el episodio de diarrea fue de 7 días. Los resultados de un estudio prospectivo con régimen de dosificación semanal no demostraron ninguna diferencia en el índice de inicio de diarrea tardía para los pacientes ≥ 65 años de edad y en pacientes <65 años de edad. Sin embargo, los pacientes con ≥65 años de edad deben ser monitoreados con cuidado por un mayor riesgo de diarrea inicial observada en esta población. Se ha observado ulceración colónica, en ocasiones con sangrado, en asociación con la diarrea inducida por irinotecan.
La diarrea tardía debe ser tratada rápidamente con loperamida al primer episodio de heces sueltas o poco formadas o el inicio de movimientos del intestino más frecuentes que los esperados normalmente para el paciente. El régimen de dosis recomendado para loperamida es 4 mg en el primer inicio de la diarrea tardía y después 2 mg cada 2 horas hasta que el paciente esté sin diarrea por al menos 12 horas. Durante la noche, el paciente puede tomar 4 mg de loperamida cada 4 horas. No se recomienda la loperamida por más de 48 horas consecutivas en estas dosis, por el riesgo de íleo paralítico, ni en menos de 12 horas. No se recomienda la medicación previa con loperamida. Los pacientes con diarrea deben ser cuidadosamente monitoreados, recibir líquidos y sustitución de electrolitos si se diagnostica deshidratación y deben recibir además antibióticos si presentan íleo, fiebre o neutropenia severa. Además del tratamiento antibiótico, se recomienda la hospitalización para el tratamiento de la diarrea en los siguientes casos:
– Diarrea asociada a fiebre,
– Diarrea grave (que requiera hidratación intravenosa),
– Pacientes con vómitos asociados con diarrea tardía,
– Diarrea que persista durante más de 48 horas después del inicio del tratamiento con loperamida en altas dosis.
Luego del primer tratamiento, los ciclos posteriores deben ser retrasados hasta que el paciente recupere la función colonica previa al tratamiento y permanezca por lo menos 24 horas sin la necesidad de medicación antidiarreica. De ocurrir una diarrea tardía toxicidad grado 2, 3 o 4, las subsiguientes dosis de Irinogen deben disminuir.
Enfermedad inflamatoria intestinal crónica y/o obstrucción intestinal
No se deberá tratar a los pacientes con irinotecan hasta tanto se resuelva la obstrucción intestinal.
Náuseas y vómitos
El irinotecan es emetogénico. Las náuseas y los vómitos pueden ser graves y generalmente se producen durante o poco tiempo después de la infusión de irinotecan. Se recomienda que los pacientes reciban agentes antieméticos como medicación previa. Los agentes antieméticos deben administrarse en el día del tratamiento, comenzando como mínimo 30 minutos antes de la administración de irinotecan. Los médicos también deben considerar la posibilidad de indicarles a sus pacientes un régimen antiemético que puedan usar posteriormente en función de las necesidades. Los pacientes con vómitos asociados con diarrea tardía deben ser hospitalizados lo antes posible para recibir tratamiento.
Mielosupresión
Se han reportado muertes en pacientes con neutropenia severa tratados con irinotecan producidas por sepsis por lo cual no debe administrarse a pacientes con mielosupresión grave. La neutropenia debe ser tratada rápidamente con soporte antibiótico. El tratamiento con Irinogen debe ser temporariamente suspendido, si durante el ciclo de terapia el recuento de neutrófilos es <1000/mm3 o si el paciente presenta neutropenia febril. Luego de la recuperación de los valores de neutrófilos por encima de 1000/mm3, los subsiguientes cursos de irinotecan, deberán ser disminuidos en su dosis, dependiendo del valor de neutropenia observado.
Pacientes con disminución de la actividad de UGT1A1
Los individuos homocigotas para el alelo UGT1A1*28 (genotipo UGT1A1 7/7) tienen un alto riesgo de neutropenia luego del inicio del tratamiento con irinotecan. En un estudio de 66 pacientes que recibieron irinotecan, como único agente, (350 mg/m2 cada tres semanas), la incidencia de neutropenia grado 4 en pacientes homocigotas para el alelo UGT1A1*28 fue del 50%, y en pacientes heterocigotos para este alelo (UGT1A1 genotipo 6/7), la incidencia fue del 12,5%. No se reportó neutropenia grado 4 en pacientes homocigotos con el alelo de tipo salvaje (genotipo UGT1A1 genotipo 6/6). En un estudio prospectivo (n=250) donde se investigó el rol del polimorfismo del UGT1A1*28 en el desarrollo de la toxicidad en pacientes tratados con irinotecan (180 mg/m2) en combinación con 5-Fu (infusión) /LV, la incidencia de neutropenia grado 4 en pacientes homocigotas para el alelo UGT1A1*28 fue del 4,5% y en pacientes heterocigotas para este alelo fue del 5,3%. Se observó neutropenia de grado 4 en el 1,8% de los pacientes homocigotos para el alelo de tipo salvaje. En otro estudio, en donde 109 pacientes fueron tratados con irinotecan (100 – 125 mg/m2) en combinación con un bolo de 5-Fu/LV, la incidencia de neutropenia grado 4 en pacientes homocigotos para el alelo UGT1A1*28 fue del 18,2%, y en pacientes heterocigotos para este alelo, la incidencia fue del 11,1%. Se reportó una incidencia de neutropenia grado 4 en el 6,8% de los pacientes homocigotos para el alelo salvaje. Cuando el irinotecan se administra con otros agentes o como agente único, se debe considerar una disminución de al menos un nivel en la dosis de irinotecan, en pacientes donde se conoce que son homocigotos para el alelo UGT1A1*28. Sin embargo, la reducción de la dosis precisa no se conoce y las subsiguientes modificaciones en las dosis deben considerarse basándose en la tolerancia individual del paciente al tratamiento.
Hipersensibilidad
Se han observado reacciones de hipersensibilidad, entre las que se incluyen reacciones anafilácticas o anafilactoides severas.
Efectos inmunodepresores /aumento de la susceptibilidad a infecciones
La administración de vacunas vivas o vivas atenuadas en pacientes inmunocomprometidos por agentes quimioterápicos, incluido el irinotecan, puede resultar en infecciones serias o fatales. La vacunación con una vacuna viva debe evitarse en pacientes que reciben irinotecan. Las vacunas muertas o inactivadas pueden administrarse; sin embargo, la respuesta a tales podría verse disminuida.
Enfermedad inflamatoria crónica intestinal y/u obstrucción intestinal
Los pacientes no deben ser tratados con Irinogen hasta la resolución de la obstrucción intestinal.
Deterioro de la función renal/insuficiencia renal
Se han informado casos de aumento en los niveles de creatinina o urea séricas. Se han identificado casos de deterioro de la función renal y de insuficiencia renal aguda, generalmente en pacientes que tuvieron agotamiento del volumen a causa de infección, nauseas, vómitos y/o diarrea grave. Asimismo, se han informado raros casos de disfunción renal debido a síndrome de lisis tumoral.
Neurológicos
Se han observado casos de mareos, que en algunos casos pueden ser una evidencia sintomática de la hipotensión ortostática en pacientes deshidratados.
Precauciones Generales
Cuidados en el sitio de inyección intravenosa Irinogen debe administrarse por infusión intravenosa. Se deben extremar los cuidados para evitar la extravasación y se debe monitorear el sitio de inyección para detectar posibles signos de inflamación. De ocurrir extravasación, se recomienda
lavar el sitio con abundante agua estéril y aplicar hielo.
Premedicación con antieméticos
Irinotecan es emetogénico. Se recomienda que los pacientes reciban medicación previa con antieméticos. En los estudios iniciales, la mayoría de los pacientes recibieron 10 mg de dexametasona en forma concurrente con un bloqueante de la 5-HT3 (por ejemplo ondansetrón o granisetrón). Los agentes antieméticos deben ser aplicados el día del tratamiento, por lo menos 30 minutos antes de la administración de Irinogen. Los médicos también considerarán dispensar a los pacientes un régimen antiemético para un uso posterior si es necesario.
Tratamiento de los síntomas colinérgicos
La administración profiláctica y terapéutica de 0,25 a 1 mg de atropina intravenosa o subcutánea debe ser considerada (a menos que este contraindicada) en pacientes con rinitis, aumento en la salivación, miosis, lacrimación, diaforesis, flushing, calambres abdominales, bradicardia o diarrea (que ocurre durante o dentro de las 8 horas posteriores a la administración de irinotecan). Se espera que estos síntomas ocurran en forma más frecuente con dosis mayores de irinotecan.
Aparato respiratorio
Se han observado casos de disnea grado 3 o 4 según la clasificación del NCI. Se desconoce en qué grado pueden haber contribuido a la disnea el compromiso pulmonar malignos u otras neumopatías preexistentes. En los primeros estudios japoneses se observó un pequeño porcentaje de pacientes con síndrome pulmonar potencialmente fatal caracterizado por la presencia de disnea, fiebre y un patrón reticulonodular en la radiografía de tórax. Fue difícil evaluar el aporte del irinotecan a estos eventos preliminares ya que estos pacientes también tenían tumores pulmonares y algunos tenían neumopatías no malignas preexistentes. La enfermedad pulmonar intersticial, que se presenta en forma de infiltrados pulmonares, es rara durante el tratamiento con irinotecan. La neumopatía intersticial puede ser fatal. Los factores de riesgo posiblemente relacionados con el desarrollo de la neumopatía intersticial son neumopatía preexistente, uso de fármacos neumotóxicos, radioterapia y factores estimulantes de colonias. Los pacientes que presentan factores de riesgo deben ser monitoreados exhaustivamente para detectar posibles síntomas respiratorios antes y durante el tratamiento con irinotecan.
Otras
Como este producto contiene sorbitol, no es apto para pacientes con intolerancia hereditaria a la fructuosa.
Poblaciones especiales
Pacientes con riesgo particular
Los médicos extremarán las precauciones al controlar los efectos del Irinogen en pacientes ancianos (mayores de 65 años) y en los que hubieran recibido antes irradiación pélvica abdominal.
Insuficiencia hepática
En los pacientes con hiperbilirrubinemia el aclaramiento de irinotecan esta disminuido y por lo tanto, el riesgo de toxicidad hematológica se encuentra aumentado. El uso de Irinogen en pacientes con una concentración sérica de bilirrubina >3,0 x el límite superior de la normalidad (LSN) administrado como agente único, en el régimen una vez cada 3 semanas no ha sido establecido. La función hepática debe monitorearse antes del inicio del tratamiento y mensualmente, como está indicado clínicamente. En los estudios clínicos de los regímenes de dosis semanales, los pacientes con elevaciones moderadas en los niveles séricos basales de bilirrubina total (1,0 a 2,0 mg/dl) presentaron una probabilidad significativamente mayor de experimentar neutropenia de grado 3 o 4 durante el primer ciclo que aquellos con niveles de bilirrubina <1,0 mg/dl (50% (19/38) vs 18 % (47/226); p <0,001). Los pacientes con glucuronidación deficiente de bilirrubina, tales como aquellos con síndrome de Gilbert, pueden presentar un mayor riesgo de mielosupresión cuando reciben una terapia con irinotecan.
Pacientes pediátricos
No se ha determinado la eficacia de irinotecan en pacientes pediátricos. Se evaluaron los resultados obtenidos a partir de dos estudios abiertos de brazo único. Se inscribieron 170 niños con tumores sólidos refractarios en un ensayo en fase 2 en el que se administraron 50 mg/m2 de irinotecan en forma de infusión durante 5 días consecutivos cada tres semanas. 54 (31,8%) pacientes experimentaron neutropenia grado 3 /4. Este cuadro se vio complicado por fiebre en 15 (8,8%) pacientes. Se observó diarrea grado 3/4 en 35 (20,6%) pacientes. Se comparó este perfil de evento adverso con lo observado en adultos. En el segundo ensayo de fase 2 de 21 niños con rabdomiosarcoma sin tratamiento previo, se administró irinotecan 20 mg/m2 en forma de infusión durante 5 días consecutivos en las semanas 0, 1, 3 y 4. Esta terapia de agente único luego siguió con terapia de multimodo. Se detuvo la acumulación en la fase de irinotecan como agente único debido a la elevada tasa (28,6%) de enfermedad progresiva y a los decesos precoces (14%). El perfil de evento adverso en este estudio fue distinto al observado en adultos. Los eventos adversos grado 3 o 4 más importantes fueron deshidratación, experimentada por 6 pacientes (28,6%), asociada a hipopotasemia grave en 5 pacientes (23,8%) e hiponatremia en 3 pacientes (14,3%); asimismo, se informaron infecciones de grado 3 – 4 en 5 pacientes (23,8%) en todos los cursos de terapia e indistintamente de la relación causal.
Pacientes geriátricos
En estos pacientes deben aplicarse específicas recomendaciones de dosificación, dependiendo del régimen utilizado.
Análisis de laboratorio
Antes de iniciar una nueva dosis de Irinogen se debe realizar un cuidadoso monitoreo de los glóbulos blancos con recuento diferencial, hemoglobina y recuento de plaquetas. Estos estudios deberán repetirse cada vez que el médico lo considera necesario.
Test para UGT1A1
Existe una prueba para determinar el estado del UGT1A1 de los pacientes. El test debe detectar los genotipos 6/6, 6/7 y 7/7 de la UGT1A1.
Estudio de desempeño (performance status)
Los pacientes con pobre estado de desempeño tienen un riesgo incrementado de presentar eventos adversos relacionados al irinotecan. Podrían aplicar recomendaciones de dosis especificas a pacientes con un Eastern Cooperative Oncology Group (ECOG) performance status (PS) de 2, dependiendo del régimen utilizado. Los pacientes con un PS de 3 o 4 no deberían recibir Irinogen. En los pacientes que recibieron irinotecan/5 FU/LV o 5 FU/LV en los estudios clínicos que compararon estos agentes, se observaron mayores tasas de hospitalización, fiebre neutropénica, tromboembolismo, discontinuación del primer ciclo de tratamiento y muertes tempranas en pacientes con un PS basal de 2 que en pacientes con un PS basal de 0 o 1.
Interacciones medicamentosas
Inhibidores de CYP3A4 y /o UGT1A1
El irinotecan y el metabolito activo SN-38 se metabolizan mediante la isoenzima del citocromo humano P450 (CYP3A4) y la enzima UDP-glucuronosil-transferasa 1A1 (UGT1A1). La administración conjunta de irinotecan con inhibidores de CYP3A4 y/o UGT1A1 puede dar como resultado una exposición sistémica mayor al irinotecan y el metabolito activo de SN-38. Los médicos deberán tener esto en cuenta cuando administren irinotecan con estos fármacos.
Ketoconazol: La eliminación del irinotecan disminuye significativamente en pacientes que reciben ketoconazol en simultáneo, lo que conlleva a una exposición mayor al metabolito activo SN-38. Deberá interrumpirse el tratamiento con ketoconazol al menos 1 semana antes de comenzar la terapia con irinotecan y no deberá administrarse durante la terapia con irinotecan.
Atazanavir (sulfato): La coadministración del atazanavir (inhibidor de CYP3A4 y UGT1A1) puede aumentar la exposición sistémica del SN-38. Los médicos deberán tener esto en cuenta cuando administren ambos medicamentos juntos.
Inductores de CYP3A4
Anticonvulsivantes: La exposición de irinotecan y SN-38 disminuye en forma substancial en pacientes adultos y pediátricos, cuando reciben en forma concomitante inductores de la enzima CYP3A4 (por ejemplo: fenitoína, fenobarbital o carbamazepina). Se deberá analizar la posibilidad de reemplazarlos o de comenzar a administrar anticonvulsivos no inductores de la enzima como mínimo, una semana antes de comenzar la administración de irinotecan en aquellos pacientes que requieran tratamiento antiepiléptico.
Hierba de San Juan: La exposición al SN-38 está disminuida en los pacientes que reciben en forma concomitante la hierba de San Juan. La hierba de San Juan debe suspenderse, como mínimo, 1 semana antes del primer ciclo de irinotecan y no debe administrarse durante el tratamiento con irinotecan.
Otras interacciones
Agentes bloqueantes neuromusculares: No se puede descartar la interacción entre el irinotecan y estos agentes, dado que el irinotecan posee actividad anticolinesterasa, que puede prolongar el bloqueo neuromuscular del suxametonio y puede antagonizar el bloqueo neuromuscular de las drogas no despolarizantes.
Agentes antineoplásicos: Es posible que los efectos adversos de irinotecan, como mielosupresión y diarrea, puedan exacerbarse con la utilización de otros agentes antineoplásicos, que tienen similares efectos adversos.
Terapia radiante: Los pacientes con antecedentes de radioterapia en región pélvica / abdominal tienen un aumento en el riesgo de mielosupresión severa luego de la administración de irinotecan. Los médicos deben tener precaución en el tratamiento de pacientes con irradiación previa extensa. Podrían aplicar recomendaciones específicas de dosificación en esta población dependiendo del régimen utilizado. No se recomienda la administración conjunta de radioterapia con irinotecan ya que esta combinación no está suficientemente estudiada.
Dexametasona: Se reportó linfocitopenia en pacientes que recibieron irinotecan y es posible que la administración de dexametasona, como profilaxis antiemética, pueda aumentar la probabilidad de este efecto. Sin embargo, no se observaron infecciones oportunistas serias, como tampoco complicaciones específicamente relacionadas con la linfopenia. Se comunicó hiperglucemia en pacientes que recibieron irinotecan. Usualmente, esta complicación se observó en pacientes con historia de diabetes mellitus o antecedentes de intolerancia a la glucosa, previo a la administración de irinotecan. También, es probable, que la administración de dexametasona en los esquemas de profilaxis antiemética, contribuya a la hiperglucemia en estos pacientes.
Proclorperazina: La incidencia de acatisia en los ensayos clínicos, con la aplicación de la droga en forma semanal, fue mayor cuando los pacientes recibieron en forma concurrente irinotecan más proclorperazina (8,5%) que cuando ambas drogas fueron administradas en forma separada (1,3%). Sin embargo, el 8,5% de incidencia de acatisia, está dentro del rango que se reportó cuando la proclorperazina se administró como premedicación con otras quimioterapias.
Laxantes: Es de esperar que el uso de laxantes durante el tratamiento con irinotecan pueda empeorar la incidencia o severidad de la diarrea, pero esto no ha sido estudiado.
Diuréticos: En vista del riesgo potencial de deshidratación secundaria al vómito y/o diarrea inducidos por el irinotecan, el médico tratante puede elegir si suspender los diuréticos durante el tratamiento con irinotecan, o restringir el uso mientras el paciente este con vómitos o diarrea.
Bevacizumab: Los resultados de un estudio destinado a evaluar la interacción droga – droga no demostraron efecto significativo del bevacizumab en la farmacocinética de irinotecan y su metabolito activo SN-38.
Interacciones con los análisis de laboratorio
No se conocen interacciones entre el irinotecan y los resultados de los análisis de laboratorio.
Carcinogénesis, mutagénesis, alteraciones en la fertilidad
No se realizaron estudios de carcinogénesis a largo plazo. Sin embargo, se administró a ratas una dosis intravenosa de irinotecan de 2 o 25 mg/kg una vez por semana, durante 13 semanas (en estudios separados, la dosis de 25 mg/kg produjo una Cmax y ABC de irinotecan cerca de 7,0 veces y 1,3 veces, los respectivos valores que la administración a pacientes con una dosis semanal de 125 mg/m2). Se permitió que los animales se recuperaran a la semana 91. Bajo esas condiciones, se observó una tendencia lineal, significativa, entre la dosis y la aparición de pólipos endometriales en el cuerno uterino y sarcomas del estroma. Ni el irinotecan ni el SN-38 fueron mutagénicos en el ensayo de Ames (in vitro). Irinotecan fue clastogénico, tanto in vitro (aberraciones cromosómicas en células de ovario de hámster chino) e in vivo (test del micronúcleo en ratones). No se observaron efectos adversos importantes sobre la fertilidad y la actividad reproductiva luego de la administración intravenosa de dosis superiores a 6 mg/kg/día en ratas y conejos.
Sin embargo, se observó una atrofia de los órganos reproductivos de los machos luego de múltiples dosis de irinotecan tanto en roedores con 20 mg/kg como en perros con 0,4 mg/kg. La radioactividad relacionada con el 14C-irinotecan atraviesa la placenta de las ratas después de la administración intravenosa de 10 mg/kg (que en diferentes estudios produjo valores de Cmax y ABC del irinotecan 3 y 0,5 veces, respectivamente, los valores correspondientes en pacientes que recibieron 125 mg/m2). El irinotecan fue teratogénico en ratas en dosis superiores a 1,2 mg/kg/día (que en estudios diferentes produjeron valores de Cmax y ABC aproximadamente 2/3 y 1/40, respectivamente, de los correspondientes valores en pacientes que recibieron 125 mg/m2) y en conejos con dosis de 6 mg/kg/día (aproximadamente la mitad de la dosis humana semanal recomendada en base a mg/m2). Los efectos teratogénicos incluyeron diversas anomalías externas, viscerales y óseas. El irinotecan administrado a las crías de ratas durante el periodo posterior a la organogénesis hasta el destete en dosis de 6 mg/kg/día provocó una disminución de la capacidad de aprendizaje y una pérdida de peso corporal en crías hembra.
Embarazo
Irinotecan es teratogénico en ratas y conejos. El irinotecan puede causar daño fetal cuando se lo administra a la mujer embarazada. No hay estudios adecuados ni bien controlados en mujeres embarazadas. Si la droga se utiliza durante el embarazo o la mujer se embaraza mientras está
recibiendo la droga, se debe avisar a la paciente sobre el potencial riesgo para el feto. Se debe comunicar a la mujer que evite el embarazo mientras esté en tratamiento con Irinogen.
Lactancia
Luego de la administración intravenosa de irinotecan radiomarcado, se pudo medir radioactividad en la leche de la rata, dentro de los cinco minutos posteriores a la aplicación y tuvo una concentración hasta 65 veces mayor que la concentración plasmática a las cuatro horas. Habida cuenta que muchas drogas se excretan por leche humana y por el potencial de reacciones adversas serias en lactantes, se debe recomendar la suspensión de la lactancia mientras la madre este recibiendo tratamiento con Irinogen.
Efectos sobre la capacidad de conducir y operar máquinas
No se ha evaluado el efecto del irinotecan sobre la capacidad de conducir u operar máquinas. Sin embargo, se debe advertir a los pacientes sobre la posibilidad de que sientan mareos o alteraciones visuales dentro de las 24 horas posteriores a la administración del irinotecan y que no conduzcan ni operen maquinas en caso de observar tales síntomas.
CONTRAINDICACIONES
Irinogen está contraindicado en pacientes con hipersensibilidad conocida a la droga o los excipientes de la formulación.